Tijdschrift voor Evidence-Based Medicine
Open-label versus dubbelblinde studies: is er een verschil in de resultaten?
Nascholing: EBM begrippen
| In deze rubriek brengt de redactie korte teksten over gangbare begrippen in Evidence-Based Medicine (EBM). |
Blind of open
In een studie met een open-label protocol zijn zowel de deelnemers als de onderzoekers/behandelaars op de hoogte van de toegediende behandeling (actieve behandeling of placebo, geneesmiddel A of B).
In experimenteel onderzoek spreekt men van blindering wanneer de betrokkenen niet op de hoogte zijn van de toegediende behandeling. In enkelblinde studies zijn de onderzoekers/behandelaars wel en de deelnemers niet op de hoogte van de toegediende behandeling. In dubbelblinde studies zijn noch de onderzoekers/behandelaars, noch de deelnemers op de hoogte van de toegediende behandeling. De toewijzing van de op te volgen gebeurtenissen kan eveneens geblindeerd voor de interventie gebeuren (in dit geval vaak centraal). In 1992 introduceerden Hansson et al. deze methodevoor open studies. Deze methode kan men evengoed toepassrn op (dubbel)blinde studies (1). In triple blinded studies ten slotte zijn noch de deelnemers, noch de behandelaars, noch de personen die de uitkomst analyseren op de hoogte van de toegediende behandeling.
Verschillen de studieresultaten naargelang het om een blind of een open-label onderzoek gaat?
Blindering en effectgrootte
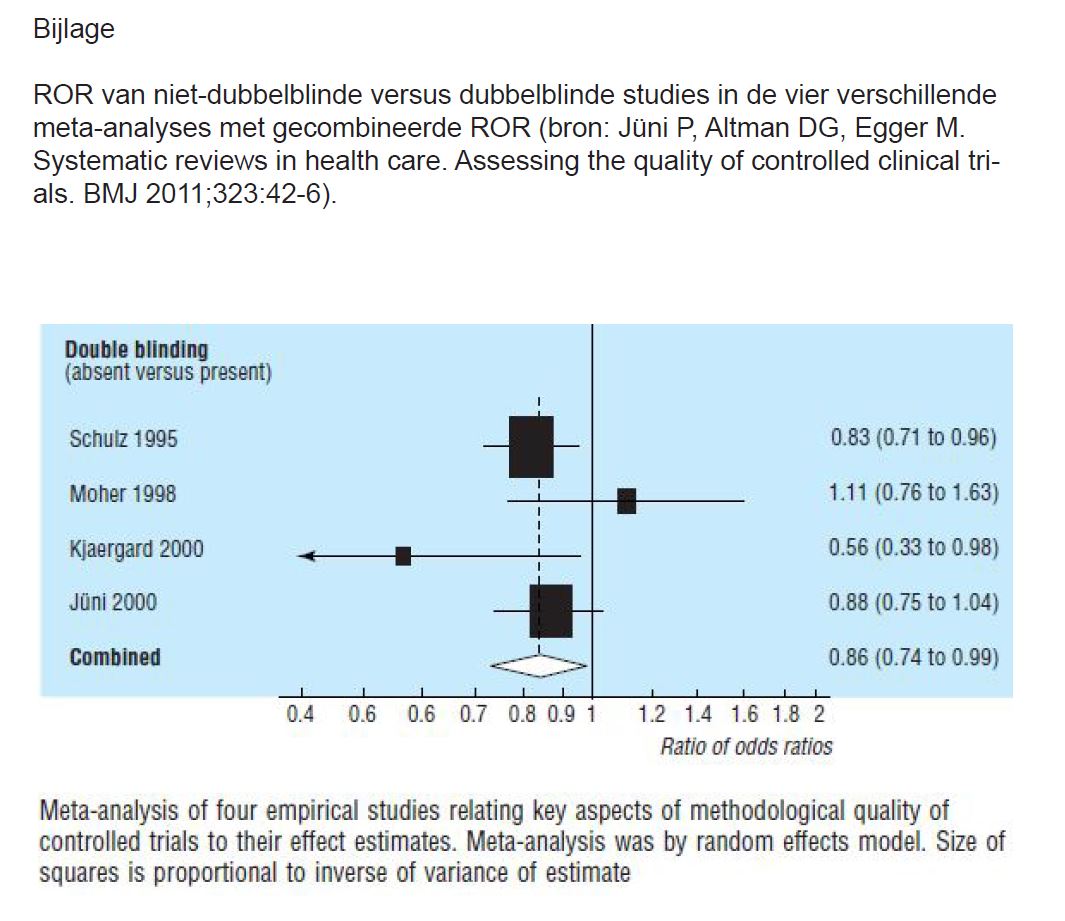
In 1995 stelden Schultz et al. vast dat verschillende elementen de effectgrootte in studies kunnen beïnvloeden (2). De effectgrootte was groter in studies zonder (duidelijke) blinde toewijzing van de deelnemers aan een onderzoeksgroep (geen concealment of allocation) of in niet-dubbelblinde studies. Jüni et al. analyseerden de resultaten van vier meta-analyses waarin de auteurs onderzochten of afwezigheid van dubbele blindering aanleiding gaf tot bias (3). In iedere meta-analyse berekenden de auteurs de verhouding van de odds ratio’s tussen dubbelblinde en niet-dubbelblinde RCT’s (=ROR, rate of odds ratios, zie vroegere methodologiebespreking in Minerva (4)). Een ROR <1 duidt aan dat het effect in niet-dubbelblinde RCT’s groter is dan in dubbelblinde RCT’s. De gecombineerde ROR van de vier meta-analyses bedroeg 0,86 (95% BI van 0,74 tot 0,99) (zie figuur in bijlage). Bero et al. onderzochten de resultaten van 192 gepubliceerde RCT’s waarin men een statine vergeleek met een ander statine of met een ander geneesmiddel (5). In een multivariaatanalyse stelden de auteurs onder meer vast dat de resultaten van adequaat geblindeerde studies (89 op 192) minder in het voordeel waren van de studiemedicatie. Ook voor de vergelijking van statines onderling leidden adequaat geblindeerde studies tot minder statistisch significante resultaten in het voordeel van de studiemedicatie: OR 0,28 (95% BI van 0,11 tot 0,73).
Blindering en betrouwbaarheid van de resultaten
Psaty en Prentice gaven in de JAMA commentaar op de RECORD-studie (6). De RECORD-studie die de cardiovasculaire risico’s van rosiglitazon onderzocht was een open-label studie, maar de toewijzing van de gebeurtenissen gebeurde geblindeerd (hospitalisatie, myocardinfarct) (7,8). Minerva bracht de RECORD-studie reeds ter sprake naar aanleiding van de bespreking van de meta-analyse van Nissen et al. over het verband tussen rosiglitazon en myocardinfarct of cardiovasculaire mortaliteit (9,10). In deze meta-analyse nam het risico van myocardinfarct en waarschijnlijk ook van cardiovasculaire sterfte toe bij type 2-diabetici behandeld met rosiglitazon in vergelijking met placebo of een ander oraal antidiabeticum. De resultaten van de RECORD-studie toonden echter aan dat rosiglitazon niet inferieur is aan metformine plus een hypoglykemiërend sulfamide voor de primaire uitkomstmaat (hospitalisatie voor cardiovasculaire reden of sterfte) zonder toename van het risico van myocardinfarct (HR 1,14; 95% BI van 0,80 tot 1,63). Het aantal gebeurtenissen in de controlegroep was echter verbazingwekkend laag. Een FDA-expert deed een onafhankelijke analyse van de resultaten van de RECORD-studie (11). De expert herbekeek de gerapporteerde gebeurtenissen (549 op 2 220 patiënten) en bracht zeer interessante elementen aan het licht. Hij stelde vast dat de blindering van de toewijzing van gebeurtenissen over het algemeen correct verliep. In 70 gevallen was er echter een probleem:: niet signaleren van gebeurtenissen, niet doorsturen van gebeurtenissen voor toewijzing, onvoldoende informatie over sommige gebeurtenissen en andere problemen bij de toewijzing. De problemen deden zich frequenter voor in de rosiglitazongroep (16,2%) dan in de controlegroep (9,2%) én voor deze probleemgevallen was het resultaat in 81% van de gevallen in het voordeel van rosiglitazon en in 19% van de gevallen in het voordeel van de controlegroep. Na een nieuwe gecorrigeerde toewijzing op basis van voor de FDA beschikbare gegevens, bedroeg de HR voor myocardinfarct in de RECORD-studie 1,38 (95% BI van 0,99 tot 1,93), een schatting die dichter aanleunt bij de resultaten van de meta-analyse van Nissen et al.
Dit voorbeeld illustreert het risico dat bij een open-label studie-opzet ongunstige gebeurtenissen op een selectieve manier niet worden doorgegeven; indien gebeurtenissen niet gerapporteerd worden, kan zelfs een centrale geblindeerde toewijzing de afwezigheid van dubbelblindheid niet compenseren of corrigeren.
Besluit
Bovenvermelde voorbeelden tonen aan hoe belangrijk blindering is in een klinische studie, zowel voor de betrouwbaarheid van de resultaten als voor de effectgrootte. Afwezigheid van blindering kunnen we dus toevoegen aan de reeks factoren die een inflatie van de effectgrootte kunnen veroorzaken. Andere factoren kwamen reeds ter sprake in Minerva: uni- of multicenter studie (4), aantal studies en aantal patiënten in een meta-analyse (12).
- Hansson L, Hedner T, Dahlöf B. Prospective randomized open blinded end-point (PROBE) study: a novel design for intervention trials. Blood Press 1992;1:113-9.
- Schultz K, Chalmers I, Hayes R et al. Empirical evidence of bias. Dimensions of methodological quality associated with estimates of treatment effects in controlled trials. JAMA 1995;273:408-12.
- Jüni P, Altman DG, Egger M. Systematic reviews in health care. Assessing the quality of controlled clinical trials. BMJ 2011;323:42-6.
- Chevalier P. Unicenter versus multicenter studies: is er een verschil in therapeutisch effect? Minerva 2011;10(10):129.
- Bero L, Oostvogel F, Bacchetti P, Lee K. Factors associated with findings of published trials of drug-drug comparisons: why some statins appear more efficacious than others. PLoS Med 2007;4:e184.
- Psaty BM, Prentice RL. Minimizing bias in randomized trials: the importance of blinding. JAMA 2010;304:793-4.
- Home PD, Pocock SJ, Beck-Nielsen H, et al; RECORD Study Group. Rosiglitazone evaluated for cardiovascular outcomes: an interim analysis.N Engl J Med 2007;357:28-38.
- Home PD, Pocock SJ, Beck-Nielsen H, et al; RECORD Study Team. Rosiglitazone evaluated for cardiovascular outcomes in oral combination therapy for type 2 diabetes (RECORD): a multicentre, randomized, open-label trial. Lancet 2009;373:2125-35.
- Chevalier P. De cardiovasculaire risico’s van rosiglitazon. Minerva 2007;6(8):126-7.
- Nissen SE, Wolski K. Effect of rosiglitazone on the risk of myocardial infarction and death from cardiovascular causes. N Engl J Med 2007;356:2457-71.
- Marciniak TA. Memorandum of June 14, 2010 on cardiovascular events in RECORD (NDA 21-071/S-035): FDA briefing document, pages 16-151.
- Chevalier P. Geloofwaardigheid en inflatie van de effectgrootte in meta-analyses. Minerva 2012;11(1):12.
Commentaar
Commentaar





